12.84消毒液是一种以次氯酸钠为主的消毒剂,主要成分为次氯酸钠(NaClO).它的消毒原理为:2NaClO+CO2+H2O═X+2HClO,则X的化学式为( )
A. NaCl B. NaHCO3 C. NaOH D. Na2CO3
考点: 质量守恒定律及其应用。
专题: 化学用语和质量守恒定 律。
律。
分析: 依据质量守恒定律可知化学反应前后各原子的种类和数目不变,故可求x的化学式.
解答: 解:由2NaClO+CO2+H2O═X+2HClO可知:反应前含有2个钠原子、2个氯离子、5个氧原子、1个碳原子和2个氢原子,反应后含有2个氢原子、2个氯原子和2个氧原子,所以x中应含有2个钠原子、1个碳原子和3个氧原子,即x的化学式为Na2CO3.
故选D.
点评: 此题考查根据质量守恒定律解决实际问题的能力,解决此类问题的关键是利用化学反应前后各原子的种类和数目均不发生变化;
13.下列区别两种不同物质的方法合理的是( )
A. 用蒸馏水区别四氧化三铁与氧化铁
B. 用酚酞试剂区别稀硫酸溶液与稀醋酸
C. 不用其他试剂,只需要组内试剂就可以鉴别氯化钡、氢氧化钠和硫酸铜
D. 用石蕊试液区别稀烧碱溶液与澄清石灰水溶液
考点: 物质的鉴别、推断;酸、碱、盐的鉴别。
专题: 物质的鉴别题。
分析: A、四氧化三铁和氧化铁都不溶于水,可以据此解答;
B、酚酞遇酸不变色,可以据此解答;
C、氯化钡可以和硫酸铜反应生成白色沉淀,硫酸铜可以和氢氧化钠反应生成蓝色沉淀,可以据此解答;
D、烧碱和石灰水都是碱,故用石蕊不能区别,可以据此解答.
解答: 解:A、四氧化三铁不溶于水,氧化铁也不溶于水,故用蒸馏水不能区别,故A错
B、稀醋酸和稀硫酸都不能使酚酞变色,所以难以区分,故B错
C、溶液呈蓝色的为硫酸铜溶液,那么能够和硫酸铜反应生成白色沉淀的为氯化钡,可以和硫酸铜反应生成蓝色沉淀的为氢氧化钠,故C对
D、烧碱溶液和石灰水都是碱的溶液,都呈碱性,所以它们都能使石蕊试液变蓝,难以区别,故D错
故选C
点评: 本题是物质的鉴别题,在解答这类题时要注意利用物质化学特性来选择合适的物质进行区分,我们所选择的物质必须与所要鉴别的物质反应,产生不同的现象,只有这样才能够区分开.
14.用分子的相关知识解释下列生活中的现象,其中错误的是( )
A. “酒香不怕巷子深”,说明分子在不停运动
B. 破碎的玻璃无法复原﹣﹣分子间存在斥力
C. 20mL酒精和20mL水混合后体积小于40mL,说明分子间有间隙
D. 湿衣服在夏天比冬天容易晾干,说明分子的运动速率随温度升高而加快
考点: 利用分子与原子的性质分析和解决问题。
专题: 物质的微观构成与物质的宏观组成。
分析: 根据分子的基本特征:分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;同种物质的分子性质相同,不同物质的分子性质不同,结合事实进行分析判断即可.
解答: 解:A、“酒香不怕巷子深”,是因为酒精中含有的分子不断运动,向四周扩散,使人们闻到酒的香气,故选项解释正确.
B、破碎的玻璃无法复原,是由于玻璃分子间的距离大于分子直径的10倍以上,超出了分子力的作用范围,分子间的作用力十分微弱,分子间几乎没有作用力;故选项解释错误.
C、20mL酒精和20mL水混合后体积小于40mL,是因为分子之间有间隔,一部分水分子和酒精分子会互相占据分子之间的间隔,故选项解释正确.
D、湿衣服在夏天比冬天容易晾干,说明夏天温度高,分子的运动速率加快,故选项解释正确.
故选B.
点评: 本题难度不大,掌握分子的基本性质及利用分子的基本性质分析和解决问题的方法是解答此类题的关键.
15.如图为元素X的某粒子的结构示意图,下列 说法正确的是( )
说法正确的是( )
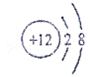
A. 该粒子可用符号“Mg+2”表示 B. 该粒子不带电
C. X元素的核电荷数为10 D. X与Cl形成的化合物为XCl2
考点: 原子结构示意图与离子结构示意图。
专题: 化学用语和质量守恒定律。
分析: 分析该微粒结构示意图可知该微粒质子数是12,核外电子数是10,所以该微粒是镁离子的结构示意图,据此对选项进行分析判断即可;
解答: 解:A、由分析知该微粒是镁离子,其符号为“Mg2+”
B、该微粒质子数是12,核外电子数是10,所以它带两个单位的正电荷;
C、由于该微粒的质子数是12,所以据原子中质子数等于核电荷数可知:X元素的核电荷数为12;
D、由于该微粒的符号是“Mg2+”,所以其化合价通常为+2价,而氯元素的负化合价通常为﹣1价,所以X与Cl形成的化合物为XCl2;
故选D.
点评: 本题考查学生对结构示意图的特点理解与应用,会根据依据结构示意图判断核电荷数,质子数,元素的种类,最外层电子数与元素的性质的关系及元素的化合价等.
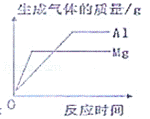
16.以下的变化曲线分别与相应的操作过程相对应,其中正确的是( )
A. |
向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体(不考虑温度变化) | |
B. |
向pH=3的稀硫酸溶液中不断加水稀释 | |
C. |
向硝酸银溶液中加入过量的氯化钠溶液 | |
D. |
将等质量的镁片和铝片分别加入过量的等溶质质量分数的稀盐酸中 |
考点: 饱和溶液和不饱和溶液相互转变的方法;金属的化学性质;酸碱溶液的稀释;溶液的酸碱性与pH值的关系;盐的化学性质;根据化学反应方程式的计算。
专题: 元素化合物知识型。
分析: A、根据没加入硝酸钾固体前溶质质量分数的变化考虑;B、根据加水后pH值的变化考虑;C、根据反应结束沉淀不再变化考虑;D、根据镁和铝与酸反应生成氢气的多少和反应速度快慢考虑.
解答: 解:A、在没加入硝酸钾固体前,该溶液是接近饱和的硝酸钾溶液,所以溶质质量分数不能是0,故A错;
B、向pH=3的稀硫酸溶液中不断加水稀释,因为水的pH值═7,所以加水后pH值不可能大于7,故B错;
C、向硝酸银溶液中加入过量的氯化钠溶液,反应完毕沉淀就不再增加,最后应改成横线,故C错;
D、等质量的镁片和铝片分别加入过量的等溶质质量分数的稀盐酸,铝产生的氢气要比镁产生的氢气多,所以铝在上边,又因为镁比铝活泼,所以镁反应的速度快,铝最先到达最高点,故D正确.
故选D.
点评: 本题容易出错的地方是D答案的判断:要从产生氢气的多少和反应的速度快慢,两个方面考虑.